L’Analyse de Risques appliquée aux Systèmes Informatisés de l’Industrie Pharmaceutique
La gestion des risques fait partie intégrante du process qualité de nombreuses entreprises provenant aussi bien du secteur de l’aéronautique, de la finance, de l’automobile ou de la santé. Dans l’industrie pharmaceutique, il permet de garantir la qualité des systèmes au cours de leur cycle de vie tout en limitant les risques pour la santé du patient et l’intégrité des données, en conformité avec les exigences réglementaires.
L’analyse de risques fait partie intégrante du management des risques des projets qualités soumis aux BPx. La méthodologie la plus répandue est celle décrite dans le GAMP 5.
Qu’est-ce qu’une analyse de risques ?
L’analyse de risques est l’estimation du risque associé à la défaillance identifiée. Il s’agit du process quantitatif et/ou qualitatif permettant d’associer la probabilité d’occurrence et la sévérité d’une défaillance. Dans certains outils de gestion du risque, la probabilité de détecter la défaillance (détectabilité) est aussi un des facteurs de l’estimation des risques (Q9 ICH Guideline).
Dans l’industrie pharmaceutique, l’analyse de risques a pour objectif l’identification et la réduction des risques impliquant la sécurité du patient, la qualité du produit, l’intégrité des données, ainsi que le respect de la réglementation en vigueur. L’analyse de risques permet de définir les moyens de réduire les risques identifiés, par l’établissement d’un effort de tests nécessaires et/ou de process et la mise en place de contrôles afin de limiter à un niveau acceptable les risques résiduels.
L’analyse de risques est généralement réalisée suivant les recommandations du GAMP 5 et suit un process qualitatif par l’estimation de différentes priorités de risques (élevé, modéré, faible) plutôt que quantitatif (calcul de scores).
Comment réaliser une analyse de risques ?
L’analyse de risques est réalisée sur la base des spécifications du système, de son environnement technique et de la réglementation en vigueur. Elle doit être réalisée en début de projet et finalisée avant le lancement des tests d’un nouveau système ou d’un système existant subissant un changement. Elle doit être documentée.
Il est recommandé d’impliquer plusieurs membres du projet (business, IT, réglementaire, …) lors de l’élaboration de l’analyse de risques afin d’assurer la couverture d’un maximum de risques. Chaque entité pourra ainsi identifier plus spécifiquement les risques liés à leurs propres process, liés à l’utilisation du système, l’infrastructure et la règlementation notamment.
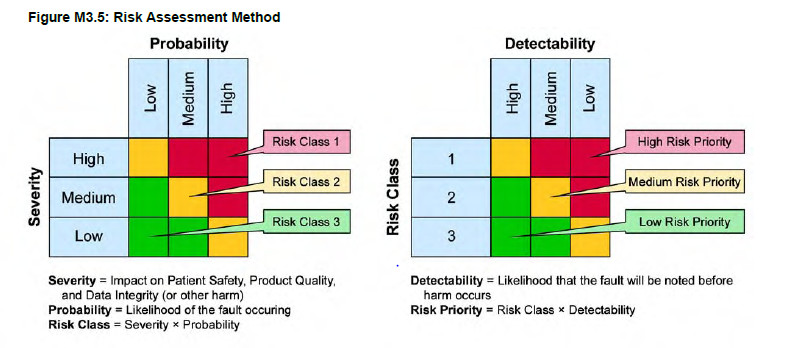
La méthodologie la plus couramment mise en place est celle décrite dans le GAMP 5 qui est tirée de l’AMDEC. Elle associe la sévérité du risque (S), la probabilité d’occurrence de la défaillance (P) et la détectabilité de la défaillance (D) afin de calculer la priorité du risque (R) :
R = S x P x D
Sévérité du risque (S) : Quel est l’impact sur la sécurité du patient, la qualité du produit ou l’intégrité des données ? D'un point de vue règlementaire ?
Probabilité d’occurrence de la défaillance (P) : quelle est la probabilité de survenue de la défaillance ?
Détectabilité de la défaillance (D) : quelle est la probabilité de détection de la défaillance ?