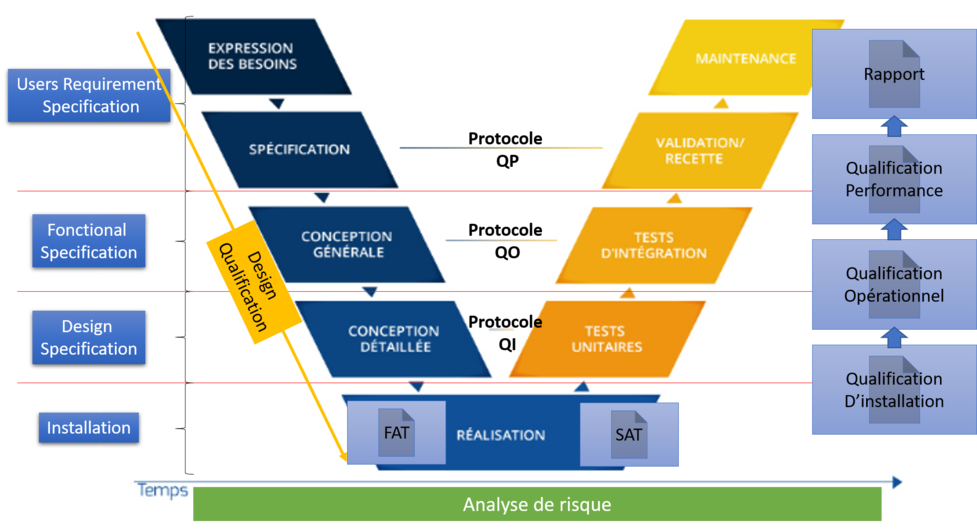
Dans les phases, nous avons :
- Les exigences qui sont définies par les éléments suivants :
- Les USR ou spécifications utilisateurs ou spécifications business
- Les FS ou spécifications fonctionnelles
- Les DS ou spécifications design
- La qualification du Design (DQ),
- Le choix de la solution.
- Les FAT ou Factory Acceptance Test (test réalisé par le fournisseur sur son site, qui permet de vérifier la bonne réponse aux exigences de la solution)
- Les SAT ou site Acceptance Test (Test réalisé par le fournisseur sur le site, qui permet de vérifier que la solution est toujours conforme aux exigences une fois installée en environnement client)
- La mise en œuvre, l’installation de la solution
- Une QI ou qualification d’installation est réalisée afin de s’assurer que les éléments sont bien installés au bon endroit et que les informations fournies par le fournisseur sont les bonnes. Cette phase permet de tracer les éléments, version, pièce, numéro de série… Il s’agit de vérifier l’adéquation avec les DS
- La QO ou qualification opérationnelle
- Elle permet de vérifier que le fonctionnement de la solution réponde à l’attendu via la mise en place de tests et de preuves documentées. Il s’agit de vérifier la concordance avec les FS.
- La QP ou qualification de performance
- Elle permet de vérifier le bon fonctionnement du processus mis en place afin de garantir le bon fonctionnement en routine, l’opération doit être reproductible 3 fois (ou plus / moins en fonction des Risk Assessment) afin de valider le bon fonctionnement du processus.
- L’autorisation d’utilisation en routine de la solution
- Après validation de tous les éléments une autorisation d’utilisation en routine et un rapport est alors rédigé avec l’ensemble des éléments. Cette étape consolide définitivement la réponse à l’URS.
Une autorisation avec une revue formalisée est faite à chaque étape afin de garantir une validation et une qualité optimum.
La réalisation des tests et l’effort à mettre en place est vu via une AR (Analyse de Risque) basée sur la réglementation en vigueur et des spécifications utilisateur (USR), entre autre, les risques business, les risques pour la santé des patients, l’architecture du système ainsi que ses composants, les CQA (Attributs qualité critiques) et CPP (Paramètres procédé critiques).
Rôles génériques clés (peuvent changer en fonction des laboratoires)
- Process owner, exprime le besoin, approuve la solution si celle-ci est conforme à l’attente,
- L’ingénierie, formalise le besoin en réponse technique, exécute les protocoles de test, installe la solution avec le fournisseur, formalise la demande de changement,
- La validation, et la Qualité, s’assure que la solution réponde aux obligations réglementaires et ne présente pas de danger pour la sécurité des patients. Cette entité, rédige, l’analyse des risques, les protocoles de test, encadre leurs exécutions, vérifie les preuves et la documentation, valide la demande de changement,
- Le fournisseur, donne la solution et la documentation associée, forme les utilisateurs et installe la solution avec l’ingénierie.
Trucs et astuces
- Respecter les étapes pour une réussite du projet dans les temps.
- Avoir l’expression du besoin le plus tôt possible afin d’identifier tout de suite l’effort de mise en place de la solution.
- Le VMP (plan de validation ou Validation master Plan) doit être à jour avec la démarche de qualification qui doit être mis en œuvre, dans l’idéale, on doit retrouver la matrice de validation qui reprend les besoins et les contraintes.
- Intégrer la réglementation en vigueur par rapport aux fonctionnalités de la solution lors de la rédaction de l’analyse de risque.
- L’écriture et l’utilisation de protocole de qualification générique demande un effort plus important au début sur la partie rédactionnelle des protocoles mais le gain de temps serra d’autant plus important une fois mis en place.
Pour rappel : Toutes les modifications doivent faire l’objet d’une demande de changement même les mises à jour de solution. Lors d’une mise à jour, si le design n’est pas modifié, il n’est pas nécessaire de refaire sa qualification sous réserve que cette possibilité soit indiquée dans les documents de gestion des process de validation (VMP par exemple).
En conclusion
Le Cycle en V sous sa forme pharmaceutique permet un séquençage des étapes afin de couvrir les différentes étapes de validation en termes de traçabilité sur un modèle 4Q (QC, QI, QO, QP), avec la notion de protocole, de tests, et de rapport. Cela nous permet d’avoir l’écriture de ce que l’on doit faire, Faire ce que l’on a écrit, et d’écrire ce que l’on a fait.