May 6, 2021
Librairie technique

En effet, la première étape consiste à définir un procédé (process design) adapté à la fabrication commerciale, sur la base des connaissances acquises lors des activités de développement et de mise à l'échelle. L'objectif de la deuxième étape, la qualification du processus (process qualification), est d'évaluer et de déterminer si la fabrication commerciale est reproductible. Pour ce faire, la qualification de la performance du processus (process performance qualification - PPQ) est nécessaire pour finaliser les qualifications des installations, des équipements et des services publics. Et enfin, la CPV est une assurance continue que le processus reste dans un état de contrôle (l'état validé) pendant la fabrication commerciale.
Un programme de validation réussi dépend de la collecte d'informations sur chaque produit au cours de la première étape. Par conséquent, le fabricant doit :
- Comprendre les sources de variation du processus,
- Détecter la présence et le degré de variation,
- Comprendre l'impact de la variation sur le processus et sur les attributs du produit,
- Contrôler la variation de manière proportionnelle au risque qu'elle représente pour le processus et le produit.
Toutes les étapes sont interconnectées et les données recueillies au cours de ce processus sont rassemblées dans l'évaluation des risques (Risk Assessment : RA - 1), la stratégie de contrôle du produit (Product Control Strategy : PCS - 2) et le plan de tendance des données (Data Trending plan : DTP - 3).
1. Évaluation des risques :
L'objectif de ce document est de cartographier tous les risques liés au produit (voir l'article sur l'évaluation des risques) pendant tout le processus (de la fabrication au stockage) et leurs effets probables sur la performance du produit. Le point clé est de réaliser cette cartographie avec les différents départements impliqués dans le processus. L'évaluation correcte des risques doit être complétée et vérifiée au moins par les départements suivants : recherche et développement, production et qualité.

Certains outils peuvent être utilisés pour structurer la gestion des risques en organisant vos données et en facilitant la prise de décision :
- Organigrammes
- Feuilles de contrôle
- Dossiers de lot
- Cartographie des processus
- Diagramme d'Ishikawa ou diagramme en arêtes de poisson.
En pratique, le groupe de travail évalue tous les paramètres du processus et les cite en fonction des CQA : Critical Quality Attributes. Un CQA est une propriété ou une caractéristique physique, chimique, biologique ou microbiologique qui doit se situer dans une limite, une fourchette ou une distribution appropriée pour garantir la qualité souhaitée du produit (en d'autres termes, vérifier si le produit répond aux spécifications inscrites dans le dossier d'enregistrement des autorités, par exemple dans les monographies). S'il y a une chance qu'une erreur se produise et puisse conduire à une erreur et à un danger potentiel sur un CQA, alors ce paramètre doit être identifié comme un paramètre critique du processus (CPP). Mais la réalité est plus compliquée que cela, il n'est pas difficile de comprendre que si un changement soudain et important d'un CPP a lieu, il aura certainement un impact sur le CQA. La difficulté ici est de définir ou de déterminer la quantité de changements d'un CPP sur le CQA.
En plus de ce chiffre, l'occurrence (nombre d'événements) et la détection doivent être renseignées. Ces informations nécessitent des données provenant des affaires réglementaires/de la qualité (pour définir le CQA), de la production (pour identifier les erreurs fréquentes qui se produisent dans l'atelier) et de la recherche et du développement (pour définir l'impact potentiel sur le produit).
De plus, ce document indique la cible et la plage associée à chaque paramètre. Elle peut être de 2 types :
- NOR - Normal Operating Range : plage utilisée en production et inscrite dans le dossier de lot (plage étroite).
- PAR - Proven Acceptance Range : plage utilisée dans le cadre de l'écart (plage plus large). Par exemple, si la production ne respecte pas la NOR, la déviation peut être fermée grâce aux données provenant du PAR.
Toutes ces données sont basées sur des dossiers d'industrialisation, Design of Experimentation (DoE), des Process Experimentation (PE) et bien sûr des dossiers de validation. Selon les directives de la FDA, tous les paramètres qui peuvent avoir un impact sur le CQA doivent être contrôlés et vérifiés soigneusement. En d'autres termes, les entreprises pharmaceutiques doivent prouver que tous les CPP sont sous contrôle en montrant les résultats des tests (avec un équipement qualifié conformément à la directive 21 CFR partie 11...) ou par une double vérification par les opérateurs.
La stratégie de test est expliquée dans la partie suivante, le PCS : Product Control Strategy.
2) Product Control Strategy (PCS)
Une PCS est conçue pour garantir qu'un produit de qualité requise sera fabriqué de manière constante. La PCS consiste à répertorier tous les tests disponibles au cours du processus, elle est basée sur la compréhension du produit et du processus et sur la gestion des risques.

Pour chaque CQA, il existe une liste de tests disponibles. Pour les autorités, les entreprises pharmaceutiques doivent prouver que le processus reste sous contrôle en utilisant une série de tests. Les éléments du contrôle qui contribuent à la qualité du produit final peuvent inclure, les éléments suivants :
- Des contrôles sur les attributs des matériaux (par exemple, les matières premières, les matériaux de départ, les solutions intermédiaires...),
- Contrôles implicites dans la conception du processus de fabrication (par exemple, la séquence des étapes de purification (substances biotechnologiques/biologiques) ou l'ordre d'ajout des réactifs (entités chimiques),
- Contrôles durant la fabrication (y compris les paramètres des tests et des procédés en cours de fabrication),
- Contrôles de la substance médicamenteuse (par exemple, tests de libération).
Il existe deux méthodes pour développer une stratégie : l'approche traditionnelle et l'approche améliorée. L'approche traditionnelle consiste à déterminer un ensemble de points et de plages étroites utilisés dans la production afin d'assurer la cohérence. Cette approche limite la flexibilité de la plage de fonctionnement pour faire face à la variabilité. En revanche, l'approche améliorée permet une meilleure compréhension du processus et du produit que l'approche traditionnelle, de sorte que les sources de variabilité peuvent être identifiées de manière plus systématique. Bien entendu, la stratégie de contrôle peut être développée en combinant plusieurs approches. Le PCS garantit que toute la gamme déterminée pour chaque CQA est correcte et cohérente, ce qui ne signifie pas que la spécification de la substance doit garantir que chaque CQA se situe dans la gamme, la limite ou la distribution appropriée. La spécification de la substance médicamenteuse est une partie de la stratégie de contrôle et tous les CQA ne doivent pas avoir une spécification. Par exemple, la confluence de la couche cellulaire ne peut pas être déterminée par une spécification. Ainsi, un CQA peut être :
- Contrôlé sur la base d'une spécification par le biais de tests de libération finale (ex : puissance)
- Contrôlé et confirmé sur la base des spécifications par des tests de libération en temps réel (RTRT) (par exemple : pH, contrôle de la température de la chambre thermique...) à un ou plusieurs endroits du processus.
- Contrôlé sur la base d'un contrôle durant la fabrication (par exemple, la confluence de la couche cellulaire).
Ces données sont ensuite analysées et renseignées dans le document Data Trending Plan (DTP).
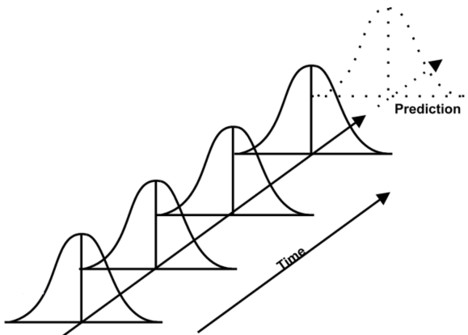
3) Data Trending Plan (DTP)
L'objectif du DTP est de collecter les données relatives aux CQA, aux CPP et aux analyses qui révèlent tout signal statistique qui devient évident au fil du temps (voir le graphique ci-dessus). Cette analyse vise à maintenir le contrôle de l'ensemble du processus dans le respect des spécifications et ne conduit donc pas à une enquête formelle. Elle est conçue pour détecter toute variation et peut également identifier les possibilités d'améliorer le contrôle du processus avant de lancer la déviation du processus.
Un processus en capacité indique qu'il fonctionne de manière constante dans le respect des spécifications. L'analyse de la capacité du processus compare donc la variation du processus aux spécifications. Elle est souvent représentée par les indices Ppk (performance) et Cpk (capacité). Le Cpk ne tient compte que de la variation au sein des sous-groupes (par exemple, les lots du jour), il ne tient pas compte du décalage ou de la dérive entre les groupes. Alors que le Ppk inclut la variation de toutes les mesures. Il tient compte à la fois de la variation au sein des sous-groupes et du décalage et de la dérive entre eux. En d'autres termes, le Cpk est un bon indice à court terme et le Ppk un indice à long terme.
Pour résumer, voici les 3 étapes de la mise en place d'une réunion CPV :
a. Définir les paramètres et les critères de signalisation :
Grâce à une approche statistique, les données provenant des tests, des enregistrements de lots, etc., sont évaluées pendant la réunion CPV pour définir les paramètres à suivre, les critères de signalisation, fixer les limites et ajuster le tableau/la gamme si nécessaire.
Les variables du processus peuvent être des causes spéciales ou communes. La portée d'un programme CPV est de maintenir les variables de causes communes stables et prévisibles ; les causes spéciales sont inhérentes à chaque processus et ne peuvent être éliminées (par exemple, inondation...).
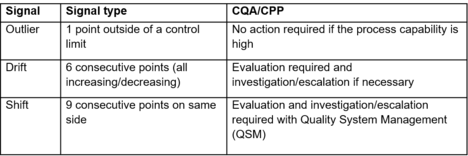
Certains signaux ne peuvent pas être caractérisés pendant l'étape d'industrialisation ou de validation. Ces signaux permettent d'évaluer les performances prévues. Il existe 2 types de contrôle de limite pour les signaux :
- Seuil d'alerte : alerte sur des données inattendues. La qualité n'est donc pas affectée. Il est généralement de 3+/- écart-type du processus.
- Seuil d'action : indique que quelque chose d'anormal s'est produit, et que la qualité du produit est compromise.
La complexité dans l'industrie pharmaceutique est que le processus utilise des cellules vivantes et que les variations sont difficiles à capturer et à caractériser. Dans tous les cas, si le signal (données provenant des CQA, CPP...) reste dans les spécifications, aucune action ne doit être entreprise. Si le signal se situe hors des spécifications, des actions et des investigations doivent être lancées (selon le système de gestion de la qualité).
b. Établir la fréquence de surveillance et d'évaluation
Cette étape intervient après avoir défini le signal et les données sur lesquels il faut se concentrer. Cette étape consiste à réagir en conséquence en temps réel en surveillant les signaux. Dans un monde idéal de fabrication, la surveillance du CPV identifie le signal en temps réel et permet d'ajuster le processus. La difficulté ici est de définir si le signal est une dérive ou un décalage. Le plan de fréquence doit prendre en compte :
- Le risque que ce paramètre s'écarte de sa plage acceptable.
- La fréquence de fabrication.
- Le niveau de connaissance historique du processus.
c. Etablir des critères d'évaluation des signaux et des actions
Le but du programme CPV est d'identifier les variations par rapport à la spécification/plage d'acceptation. Mais il peut y avoir des variations à l'intérieur de la plage d'acceptation, il est donc important d'adapter la réponse du signal :
- Aucune action requise : la réponse est dans la variation du signal, il n'y a pas assez de données significatives pour aller plus loin (analyse des causes profondes, CAPA...).
- Évaluation : la réponse ne correspond pas au signal attendu à partir des données collectées. Elle nécessite une évaluation technique pour en comprendre la cause. En fonction de la cause déterminée, un CAPA peut être nécessaire.
- Escalade : la réponse ne correspond pas au signal attendu à partir des données collectées. Elle nécessite un impact sur le produit (de la part d'un expert technique, par exemple des PME...) et une analyse de la cause fondamentale. Le signal est suivi par le SMQ (par exemple avec CAPA).
Il existe différents tableaux/graphiques sur différentes bibliothèques techniques qui expliquent comment répondre en fonction des données, le graphique 1 montre un exemple de stratégie basée sur le risque qui pourrait être utilisée pour développer un plan CPV. Il est important de noter que toutes les informations doivent être analysées et tenir compte de la variabilité d'un lot à l'autre, des équipes, des usines...
Conclusion
Le défi des entreprises pharmaceutiques est d'exécuter la fabrication selon le cycle de vie de la validation du processus et ainsi, de respecter la qualité demandée par les autorités. Si le CPV est correctement géré et établi, cela signifie que la qualité du produit répond aux critères souhaités (en améliorant la connaissance du produit/processus). Ce programme aide les entreprises pharmaceutiques à se préparer aux attentes des inspections réglementaires. En effet, les agences réglementaires telles que la FDA, l'OMS, l'EMA... fournissent des conseils pour promouvoir ce programme. Les dernières tendances des lettres d'avertissement 2020 continuent d'indiquer qu'il existe un écart évident dans la compréhension et l'adoption des idées de base.
Cela changerait, à long terme, la façon dont le processus de fabrication est géré : La fabrication passe d'un modèle réactif à un modèle proactif.
Références:
https://www.fda.gov/files/drugs/published/Process-Validation--General-Principles-and-Practices.pdf
https://www.researchgate.net/publication/321977835_Continued_Process_Verification_Statistical_Tools_for_Process_Control_and_Improvement_A_Systems_Approach/link/5a3bf358a6fdcc21d877ef01/download
https://www.biopharminternational.com/
https://www.fda.gov/media/71535/download
https://www.fda.gov/files/about%20fda/published/Control-Strategy-and-ICH-Q11--John-Smith--Ph.D.--October-18--2012--AAPS-Annual-Meeting.pdf
https://www.researchgate.net/publication/321977835_Continued_Process_Verification_Statistical_Tools_for_Process_Control_and_Improvement_A_Systems_Approach/link/5a3bf358a6fdcc21d877ef01/download
https://www.pharmaceuticalonline.com/doc/put-your-continued-process-verification-cpv-data-to-work-0001
-
Librairie technique
21 janv. 2021
Événement N'tech : L'analyse de risques, le point clé du processus de qualification
Premier webinaire N'tech autour d'un sujet des sciences de la vie
-
Librairie technique
8 oct. 2019
Risk Analysis Approach for Computerized Systems
The goal: reduce risks in accordance with applicable regulations
-
Librairie technique
6 mai 2019
All you need to know about the Ishikawa diagram
Everything you have ever wondered about the Ishikawa diagram will be revealed